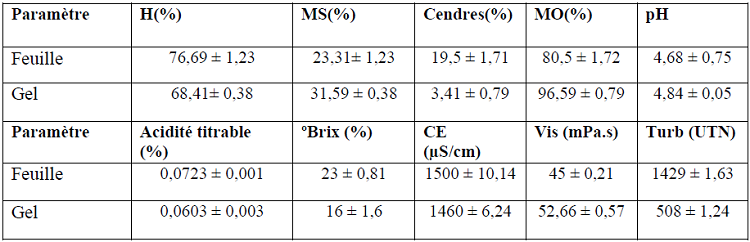
Les résultats des analyses physico-chimiques du gel et de la purée des feuilles d’Aloe arborescens sont donnés dans le tableau 11 ci-dessous.
Tableau 11 : Caractéristiques physico-chimiques du gel et de la purée des feuilles d’Aloe arborescens
L’analyse statistique a montré que les résultats obtenus concernant les paramètres physicochimiques du gel et de la purée des feuilles sont significativement différents (P < 0,05).
a. Humidité
Selon le tableau 11, le taux d’humidité des feuilles et du gel respectivement est 76,69 ± 1,23% et 68,41 ± 0,38%, leur teneur en matière sèche est estimée à 23,31 ± 1,23% pour les feuilles et à 31,59 ± 0,38% pour le gel. Ces résultats sont logiques, car la feuille inclue le gel et l’épiderme, donc plus riche en eau et en matière sèche.
Nos résultats sont largement supérieurs à ceux trouvés par Miranda et ses collaborateurs (2010), qui a étudié l’humidité des feuilles de l’espèce Aloe vera (55,68 ± 1,09 %).Ces différences peuvent être expliquées par la composition spécifique pour chaque espèce du genre Aloe.
b. Cendres
D’après le tableau ci-dessus, la teneur en cendres des feuilles est égale à 19,5 ± 1,71%, supérieure à celle du gel (3,41 ± 0,79%), alors que la matière organique constitue 96,59 ± 0,79 % du gel avec un pourcentage de 80,5 ±1,72%.
Selon Miranda et ses collaborateurs (2010), la teneur en cendres dans le gel d’Aloe vera est de 17,62 ± 1,72%, cette valeur est largement supérieure à celle de notre gel (3,41 ± 0,79%). cette différence pourrait être expliquée par la variabilité de la composition entre ces deux espèces et aussi par des pertes lors de la manipulation.
c. pH
Le pH est l’un des trois paramètres utilisés habituellement pour l’évaluation et l’identification des gels commerciaux des aloès (avec la conductivité électrique et le taux d’acide malique).
Selon tableau 11 on constate que le pH du gel (4,84 ± 0,05) est un peu supérieur à celui de la feuille (4,68 ± 0,75).
La valeur obtenue du pH de gel étudié, est largement inférieure à celle obtenue par O’Brien (2005), qui a travaillé sur la même espèce (pH= 6,8 ± 0,02), cette différence pourrait être due au temps et à la saison de récolte. Selon le même auteur, l’acide malique atteint sa concentration maximale dans les premières heures du matin en abaissant la valeur du pH, et sa concentration minimale l’après-midi. Cependant, notre valeur elle est similaire à celle trouvée par Zapata et autres (2013) où le pH prend la valeur : 4,78 ± 0,05.
Zapata et collaborateurs (2013), ont montré que le pH des aloès peut atteindre sa valeur maximale en hiver, alors que la valeur minimale était en été.
d. Acidité titrable
L’acidité titrable ou le taux de l’acide malique, est un excellent indicateur de fraîcheur du gel. L’acide malique est produit naturellement dans les feuilles des aloès, ainsi que d’autres plantes succulentes.
Selon le tableau précédent, l’acidité titrable des feuilles est égale à 0,0723 ± 0,001%, un peu supérieure à celle du gel (0,0603 ± 0,003%).
Nos résultats sont similaires à ceux de Miranda et ces collaborateurs (2009), en étudiant le gel d’Aloe vera qui a une acidité titrable allant de 0,037 ± 0,007% à 0,065 ± 0,002%, et à ceux de Navarro et al, (2009), où l’acidité titrable du gel d’Aloe vera est égale à 0,053 ± 0,02%.
e. Le degré Brix
Le tableau 11 montre que la teneur totale en solides solubles (°Brix) est de 23 ± 0,81 % et 16,6 ± 01,6 % pour les feuilles et gel respectivement. Ce paramètre permet d’évaluer la concentration en sucres solubles.
Ces résultats sont largement supérieurs à ceux de Zapata et ces collaborateurs (2013), qui a obtenu un degré Brix du gel allant de 1,91 ± 0,4 % à 2,15 ± 00,2 %.
Selon O’Brien (2005), la teneur en solides solubles dans le gel des aloès varie en fonction de la composition du sol.
f. Conductivité électrique
La conductivité électrique est un paramètre important pour l’évaluation de la qualité des gels des aloès et donne une idée sur l’état de fraicheur de celui-ci .Elle est faible lorsque le gel est frais, et augmente en perdant la fraicheur de celui-ci (O’Brien, 2005).
D’après le tableau ci-dessus, la conductivité électrique de la feuille (1500 ± 10,14 μS/cm) est très proche de celle du gel (1460 ± 6,24 μS/cm).
Ses résultats sont inférieure à ceux d’O’Brien (2005), la conductivité électrique du gel est de 3510 ± 5,2 μS/cm. cette différence pourrait être due à la différence en teneur en sels minéraux.
g. Turbidité
La turbidité du gel est de 508 ± 1,24 UTN, elle est inferieurs à celle des feuilles (1429 ± 1,63 UTN).
Ces valeurs sont compatibles avec la texture du gel qui est presque transparente et la feuille est trouble et contient beaucoup de particules en suspension.
h. Viscosité
La viscosité du gel (52,66 ± 0,57 mPa.s) est largement supérieure à celle des feuilles (45 ± 0,21 mPa.s).Ceci pourrait être expliqué par le taux d’humidité élevé des feuilles (76,69 ± 1,23 %) comparé à celui du gel (68,41 ± 0,96%), ce qui baisse la viscosité.
i. Test d’amidon
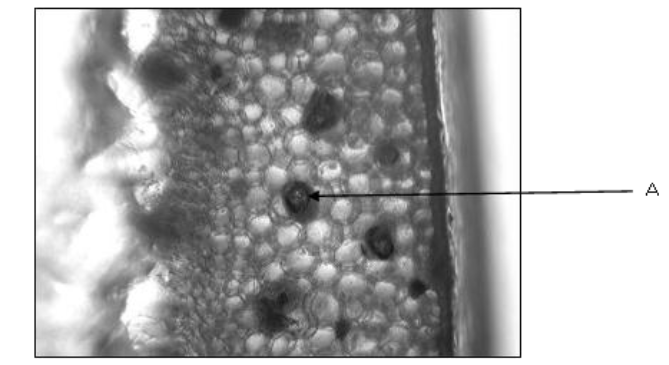
La photo ci-dessous illustre une coupe transversale de la feuille d’Aloe arborescens sous microscope optique après traitement par l’acide acétique et l’iodure de potassium.
Photo 05 : Les tâches d’amidon sur une coupe de la feuille d’Aloe arborescens sous microscope optique (40x)
La photo 05 montre la présence des tâche noires de forme presque arrondie et irrégulière, ces dernières constituent selon Femenia et ses collaborateurs (1999) l’amidon, qui se répartie d’une façon irrégulière dans toute la feuille ,sous forme de vésicules réagissant avec l’iode issu de la solution d’iodure de potassium (30%) en formant des taches noires, ces dernières sont bien claires sur notre coupe.
j. Potentiel de changement de la couleur du gel
La figure ci-dessous représente les différentes phases de changement de la couleur du gel d’Aloe arborescens sous l’effet de NaOH (1M) sans ou avec chauffage (90°C).
Photos 06 : Changement de la couleur du gel d’Aloe arborescens avant et après traitement par NaOH (1M) sans chauffage (A et B), et avec chauffage (90ºC) /1 min (C), et après 6 minutes de chauffage (D).
Le gel avant traitement avec le NaOH avait une couleur transparente, c’est la couleur normale d’un gel frais non oxydé, après l’ajout de cette base, sa couleur change vers une couleur jaune claire. Selon O’Brien (2005), le gel contient peu de polyphénols et donc sa couleur est claire, quand celui-ci est contaminé par les composés phénoliques de la feuille, sa couleur deviens foncée après ajout du NaOH.
Après un chauffage d’une minute, la couleur devient orange clair, et après 6 minutes elle est orange foncée, cette intensification de la couleur en prolongeant le temps de chauffage pourraient être expliquées par l’accélération de phénomène d’oxydation des composés phénoliques et d’autres molécules antioxydante. Ces résultats sont similaires à ceux trouvé par O’Brien (2005).
Le test de changement de couleur de gel des aloès est indispensable pour le contrôle de l’état de fraicheur des produits commerciaux à base de ce dernier.
k. Teneur en vitamine C
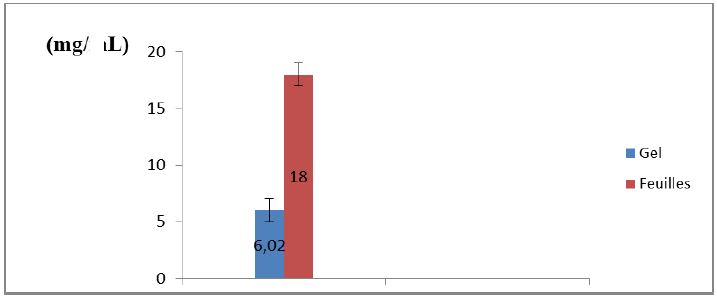
Les résultats obtenus de la teneur en vitamine C dans le gel et les feuilles d’Aloe arborescens sont illustrés par la figure suivante.
Figure 07 : Teneur en vitamine C dans le gel et feuilles d’Aloe arborescens
L’analyse statistique (test Student) révèle une différence significative entre la teneur en vitamine C entre feuilles et gel (P < 0,05).
Selon la figure 07, on constate que la concentration de la vitamine C dans les feuilles est égale à 18 ± 0,92 mg/L, cette valeur est supérieure à celle du gel où la concentration en vitamine C est de 6,02 ± 0,54 mg/L. Donc la feuille est plus riche en vitamine C que le gel.
l. Teneur en protéines et en azote total
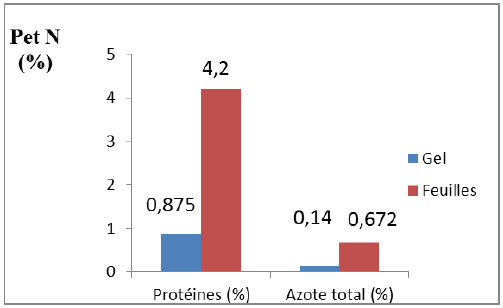
La figure 08 représente les résultats obtenus concernant la teneur en protéines et en azote total dans le gel et les feuilles d’Aloe arborescens.
Figure 08 : Teneur en protéines et en azote total du gel et feuilles d’Aloe arborescens
L’analyse statistique (test Student) révèle une différence significative entre la teneur en protéines et en azote total des feuilles et du gel (P < 0,05).
Les résultats obtenus révèlent que, la feuille est plus riche en protéines et en azote total (4,2 % et 0,672 % respectivement), comparée au gel (0,875 % et 0,14 % respectivement).
Les résultats obtenus concernant la teneur de gel en protéines sont supérieurs à ceux de Zapata et ses collaborateurs (2013), où la teneur varie de 0,26 ± 0,01% et 0,54 ± 0,05%.
Ces différences peuvent être due aux : conditions climatiques, à l’âge de la plante, à la saison de récolte et aux conditions de travail au laboratoire.
Zapata et ses collaborateurs (2013) ont montré que, la quantité des protéines dans le gel d’Aloe arborescens varie en fonction des saisons, celle-ci atteint sa valeur maximale en été.
m. Teneur en lipides (matière grasse)
La figure ci-dessous illustre la teneur en lipides du gel et de la feuille déterminée par la méthode de Soxhlet.
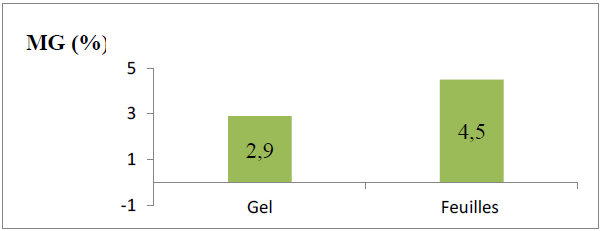
Figure 09 : Teneur en matière grasse du gel et feuilles d’Aloe arborescens
L’analyse statistique (test Student) révèle une différence significative entre la teneur en lipides des feuilles et du gel (P < 0,05).
Selon la figure ci-dessus, les lipides constituent 4,5% de PF de la feuille, alors qu’elles ne constituent que 2,9% du poids PF du gel.
Nos résultats sont largement supérieurs à ceux de Zapata et ces collaborateurs (2013), où la teneur en lipides dans le gel varie de 0,13 ± 0,03 % à 0,42 ± 0,02%.
Selon Zapata et ces collaborateurs (2013), la teneur en lipides dans le gel des aloès varie en fonction des saisons et atteint sa valeur maximale en été.
n. Teneur en sucres totaux
Les résultats obtenus concernant la teneur en sucres totaux de la feuille et du gel sont illustré par
la figure ci-dessous.
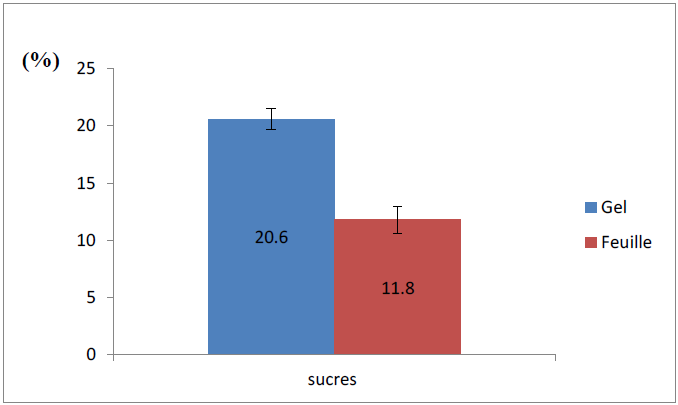
Figure 10 : Teneur en sucres totaux du gel et des feuilles d’Aloe arborescens
L’analyse statistique (test Student) révèle une différence significative entre la teneur en sucres des feuilles et du gel (P < 0,05).
D’après la figure précédente, les sucres totaux constituent 11,8 ± 1,02% du PF de la feuille, alors qu’ils constituent 20,6 ± 0,9% du PF du gel.
On remarque que les sucres sont répartis beaucoup plus dans le gel que dans la feuille, ce qui est en accord avec les données rapportées par Li (2009).
o. Teneur en minéraux et en métaux lourds
Les concentrations des éléments minéraux et des métaux lourds obtenues par SAA sont comparées par rapport à des courbes d’étalonnage pour chaque élément (Annexe 2).
– Les éléments minéraux (oligoéléments)
La figure 11 représente la teneur en oligoéléments dosés dans les feuilles et le gel.
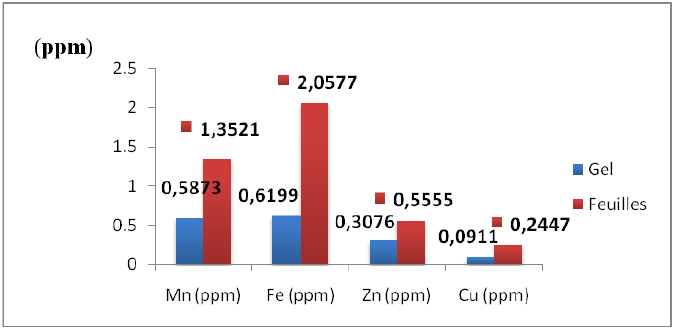
Figure 11 : Teneur en éléments minéraux du gel et des feuilles d’Aloe arborescens
L’analyse statistique (test Student) révèle une différence significative entre les concentrations des éléments minéraux (oligoéléments) du gel et de la feuille (P < 0,05).
– Le Manganèse
Selon la figure 11, la concentration en Manganèse des feuilles (1 ,3521 ppm) est supérieure à celle du gel qui contient 0,5873 ppm.
Comme nous avons déjà vu, le rendement du gel dans la feuille était 50,36% et donc la concentration du manganèse dans l’épiderme est de à 2,1169 ppm environ. Cette valeur est largement supérieure à celle du gel avec un écart de 1,5296 ppm.
D’après ces résultats on résume que le Manganèse se répartit beaucoup plus dans l’épiderme de la feuille avec un pourcentage de 72,25% de toute la fraction du Manganèse.
– Le fer
La figure ci-dessus montre que la concentration en fer des feuilles est égale à 2,0577 ppm, cette dernière est supérieure à celle du gel qui a une concentration de 0,6199 ppm.
On peut remarquer selon la figure précédente que le fer constitue la fraction majeure des éléments dosés.
En fait, la concentration du fer dans l’épiderme de la feuille doit être égale à 3,4955 ppm avec un rendement du gel dans la feuille égal à 50,36%, cette valeur est largement supérieure à celle du gel avec un écart de 2,87 ppm.
On remarque que le fer est répartit avec sa grande partie dans l’épiderme de la feuille avec un pourcentage de 82,26% de toute la fraction du fer trouvée dans la feuille complète.
– Le zinc
Selon toujours la figure 11 la concentration en zinc dans les feuilles est 0,5555 ppm et supérieure à celle trouvée dans le gel (0,3075ppm).
En considérant que le rendement du gel dans la feuille est égal à 50,36%, la concentration du zinc dans l’épiderme de la feuille doit être égale à 0,8035 ppm.
D’après ces résultats on résume que la grande fraction du zinc (72,32%) se trouve dans l’épiderme de la feuille.
– Le cuivre
La figure 11 montre que la concentration du cuivre dans le gel et les feuilles reste inférieure à celles des autres éléments, la teneur en cuivre dans la feuille est 0,2447 ppm, cette valeur est supérieur à celle du gel (0,0911ppm).
Pour la concentration du cuivre dans l’épiderme ; elle est égale à 0,39 ppm, elle constitue 81,38% de tout la fraction du cuivre.
D’après ces résultats on peut dire que le cuivre répartit avec sa grande concentration dans l’épiderme de la feuille et le reste se répartit dans le gel avec un pourcentage de 37,22% de toute la fraction du cuivre.
. Les métaux lourds
La figure 12 illustre la teneur en métaux lourds dosés du gel et des feuilles.
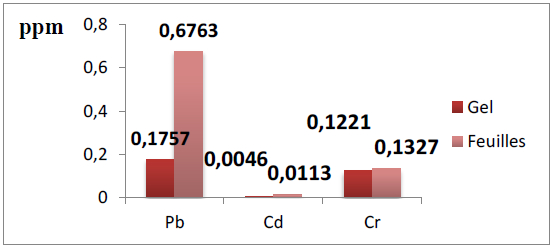
Figure 12 : Teneur en métaux lourds des feuilles et du gel d’Aloe arborescens
L’analyse statistique (test Student) révèle une différence significative entre les concentrations des métaux lourds du gel et de la feuille (P < 0,05).
– Le plomb
On constate selon la figure ci-dessus que le plomb constitue l’élément majeur des métaux lourds dosés.
La concentration du plomb dans les feuilles est 0,6763 ppm, cette dernière est largement supérieure à celle du gel où la concentration en plomb est 0,1757 ppm.
La concentration du plomb dans l’épiderme de la feuille est égale à 1,1956 ppm environ pour un rendement du gel dans la feuille égal à 50,36%.
On peut également constater que la grande partie du plomb (87,25%) est trouvée dans l’épiderme de la feuille, cette concentration élevée peut être due au site où se cultivée cette plante ; c’est un site exposé au différentes émissions issues des moteurs à combustion interne des véhicules.
Selon Reynolds (2004) la concentration du plomb dans le gel ne doit pas dépasser 0,4 ppm, la concentration du plomb dans notre gel est 0,1757 ppm, cette valeur est inférieure à 0,4 ppm ce qui rend le gel acceptable.
– Le cadmium
Selon toujours la figure 12, le cadmium constitue la partie mineure des métaux lourds dosés, avec une concentration de 0,0113 ppm dans la feuille et 0,0046 ppm dans le gel.
Pour la concentration du cadmium dans l’épiderme de la feuille, elle est égale à 0,018 ppm. Donc on peut dire que le cadmium répartit beaucoup plus dans l’épiderme de la feuille.
Pour la concentration du cadmium dans le gel Reynolds (2004) a montré que la limite est 0,1 ppm ce qui rend notre gel accepté.
– Le chrome
Comme le montre la figure 12, la concentration du chrome dans les feuilles (0,1327ppm) est supérieure à celle du gel (0,1221ppm).
La concentration du chrome dans l’épiderme de la feuille est égale à 0,1433 ppm qui semble inférieure à celle du gel.
On résume que la concentration du chrome dans le gel est proche à celle de la feuille.
Page suivante : II.5. Analyse phyto-chimique du gel et feuilles