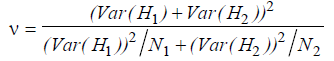1) Sélection des sites d’inventaire
Les sites à inventorier au sein de la réserve, dans le but de déterminer les hotspot d’amphibiens à suivre dans le futur, ont préalablement été sélectionnés par analyse cartographique. Cette étape a été réalisée à partir de la base de données cartographique de l’ONG étudiée avec le logiciel libre de cartographie SIG QuantumGIS (Qgis version 1.6.0). Cette base de données comprend notamment des informations sur le périmètre de gestion de la réserve par l’ONG et l’occupation du sol.
La présélection des sites s’est faite en fonction de :
– la présence d’un grand point d’eau (canal, lac, mare) dans les environs afin de maximiser le nombre d’observations, les amphibiens étant, de par leur mode de vie, intimement liés à l’eau.
– la représentation des divers types de milieux (savane, zone dégradée, forêt dense composée d’espèces endémiques, forêt marécageuse de niaouli et marécage) autour de ces points d’eau afin d’inventorier l’éventail de diversité spécifique le plus large possible
– l’accessibilité du site : le suivi doit pouvoir être continu dans le temps ce qui sous-entend des inventaires reproductibles. Pour cela le site doit pouvoir être accessible (accès par des chemins tracés plutôt que par traversée aléatoire de la forêt) et être retouvé aisément.
Les différents types de milieux sont nommés selon la nomenclature choisie par MATE. Ainsi, on entend par savane une zone ayant subie une déforestation lors de l’incendie de 2002 et ayant été recolonisée par une espèce de bruyère appartenant au genre Philippia qui est une espèce invasive originaire d’Océanie. De même, une zone dégradée désigne également une zone incendiée mais dont la végétation est principalement représentée par une fougère (non invasive) et quelques arbres du voyageur (Ravenala madagascariensis) qui résistent aux incendies et poussent aisément en zone dégradée.
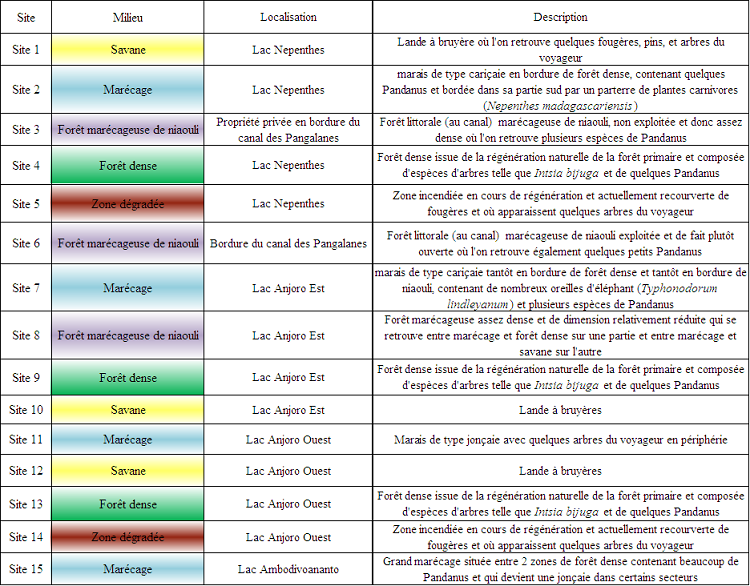
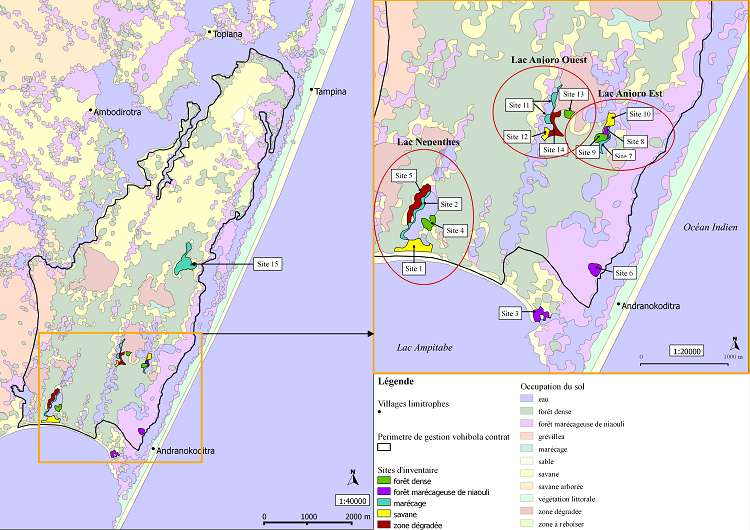
Suivant les critères cités plus haut, un total de 15 sites a été prospecté. Parmi ces 15 sites (cf. Carte 1) :
– on compte 4 marécages, 3 forêts denses, 3 forêts marécageuses de niaouli, 3 savanes et 2 zones dégradées.
– 12 sites sont regroupés autour de 3 lacs à raison de 4 sites par lac. Comme un seul de ces lacs est limitrophe d’une forêt marécageuse de niaouli, 2 sites de ce type de milieu ont été sélectionnés sur la côte orientale de la réserve qui borde le canal, c’est-à-dire là où on retrouve majoritairement le niaouli. Le 15ème et dernier site sélectionné est un grand marécage choisi sur la base de sa potentielle richesse spécifique, mise en exergue par l’inventaire biologique de la réserve réalisé en 2005 (Randrianirina, 2005).
– L’une des forêts marécageuses de niaouli retenue (site 3) ne se situe pas à proprement parlé dans la réserve bien qu’elle fasse partie du même territoire (cf. Carte 1). Il s’agit d’une parcelle en propriété privée. Le choix s’est porté sur ce site, car ne faisant pas partie de la zone de gestion de MATE, il n’est pas soumis à l’exploitation pour la production d’huiles essentielles. Par ailleurs, il n’est pas non plus exploité par les propriétaires de cette parcelle.
Le deuxième site de ce type se trouve également en bordure de canal mais au sein de la zone de gestion et subit donc une exploitation. Ceci permet alors de distinguer deux sites d’un même habitat mais dont les propriétés d’exploitation ne sont pas les mêmes. Le troisième site correspondant à ce type de milieu se situe quant à lui à l’intérieur de la réserve et borde un lac. Il fait alors office de milieu de transition entre marécage et forêt d’une part et entre marécage et savane d’autre part.
Le Tableau 1 résume l’ensemble de ces informations et reprend les caractéristiques principales de chaque site inventorié.
Tableau 1 : Description des sites d’inventaire
Carte 1 : Localisation des sites d’inventaire
2) Inventaire
La méthodologie d’inventaire des grenouilles dans la réserve de Vohibola se base sur le protocole standardisé proposé par Arnaud LeGoff (LeGoff, 2008) et validé par l’expert herpéthologue de Conservation International à Madagascar, Mr Nirhy Rabibisoa. Ce protocole préconise notamment la recherche des amphibiens par “chasse à vue”, méthode la plus employée pour ce genre d’étude (Daly & al., 2008 ; Andreone & al ., 2000, 2006 ; Vallan et al ., 2000, 2002, 2004). La méthode des pitfalls (pièges à fosse) s’est quant à elle souvent avérée inefficace car elle ne permettait pas d’observer d’èspèces différentes de celles identifiées par chasse à vue (Andreone & al., 2000, 2006), et n’a donc pas été réalisée pour cette étude. Cette méthode avait d’ailleurs été expérimentée à Vohibola lors d’un inventaire en 2007, mais n’avait permis aucune capture (Deschamps, 2007).
La méthodologie de la présente étude reprend alors les principaux éléments du protocole standardisé, avec toutefois quelques modifications :
– Selon cette méthodologie, par exemple, il est demandé à l’expérimentateur de relever l’hygrométrie au moment de l’inventaire. Cependant, l’ONG ne disposant pas du matériel nécessaire, ce facteur n’a pu être mesuré.
– Le protocole préconise également de relever, lors de la session d’inventaire, un paramètre appelé “distance à l’eau”. Ce paramètre correspond à la distance du point d’eau le plus proche à laquelle se trouve un individu observé. Techniquement, sur le terrain ce paramètre est extrêmement difficile à mesurer en raison de ce qui peut être désigné comme “point d’eau”. En effet, dans une forêt dense, un simple receuil d’eau dans une coquille vide d’escargot peut constituer un lieu de ponte pour certaines espèces. Il devient dès lors impossible de savoir à quelle distance une grenouille se situe du point d’eau le plus proche.
De ce fait, le paramètre “distance à l’eau” a été jugé non pertinent et n’a pas été pris en compte lors de cette étude.
– Le protocole standardisé n’envisage qu’une identification à vue (selon des caractéristiques morphologiques) alors qu’ici l’identification est réalisée à la fois de manière visuelle et acoustique.
– En ce qui concerne l’analyse des résultats, un indice de biodiversité supplémentaire (indice de Hill) a été calculé, en plus des indices recommandés (indices de Shannon et Simpson), afin d’affiner l’analyse de la diversité spécifique de chaque site d’échantillonnage.
Période d’inventaire
Les inventaires se sont déroulés sur une période de trois mois, entre le 13 février et le 15 avril, à raison de trois sessions de quinze jours. Soit une première session du 13 au 27 février, une seconde entre le 16 et le 30 mars et une troisième et dernière session du 2 au 15 avril.
Méthode
Les inventaires de chaque site ont toujours été effectués en binôme, c’est-à-dire avec la participation d’un guide du village, employé de MATE. L’inventaire est réalisé par transect d’une heure (effort d’échantillonnage constant) avec fouille systématique des micro-habitats (litière, arbustes, flaques d’eau…). Un transect respectant une limite de temps est préféré à un transect soumis à une contrainte de taille afin de favoriser un même effort d’échantillonnage : 100m à travers une forêt dense ne représente pas le même effort de recherche que 100m dans une zone dégradée.
Les transects sont réalisés sur chaque site de jour et de nuit. Tous les sites sont donc inventoriés six fois en tout : deux fois (jour et nuit) par session, sauf pour certains sites qui n’ont pas été trouvés lors de la première session et ont donc été inventoriés quatre fois.
Le jour, les prospections ont lieu entre 5h30 et 7h00, au lever du soleil, afin de détecter les espèces diurnes avant que le soleil ne soit trop haut dans le ciel et donc qu’il ne fasse trop chaud (les grenouilles ayant tendance à se protéger du soleil en se réfugiant dans des troncs d’arbre ou sous les feuilles par exemple, elles deviennent alors difficiles à détecter). L’inventaire de nuit quant à lui se déroule après le coucher du soleil, entre 18h et 20h, ce qui permet d’observer et surtout d’entendre les espèces nocturnes.
Pour chaque site les paramètres suivants sont renseignés lors de l’inventaire (cf. Annexe IV) :
– Date et heure
– Météo et température
– Coordonnées GPS du transect
– Description du milieu
– Données de l’inventaire à proprement parler : espèce observée, nombre d’individus, stade et sexe, mode de détection, mode d’identification et n° des photos.
Au début de la session d’échantillonnage, un thermomètre est placé au sol afin de déterminer la température. La température n’est alors relevée sur la fiche d’inventaire qu’après avoir renseigné les autres données (Météo, coordonnées GPS…), soit environ 5 mn. Les coordonnées géographiques sont acquises grâce à un GPS Garmin etrex modèle venture HC. Lorsque toutes ces données sont notées, le chronomètre est démarré et la prospection le long du transect débute.
En pratique, dès qu’un individu est repéré, une ou plusieurs photos sont prises (afin de pouvoir identifier l’individu ultérieurement) puis, si possible, l’individu est temporairement capturé et placé dans le seau prévu à cet effet. L’identification se réalise alors quand le temps de recherche est écoulé afin de bien dissocier temps de recherche et d’identification et ainsi respecter un même effort d’échantillonnage entre les sites. Plusieurs critères contribueront alors à l’identification.
3) Identification
Ne disposant pas du matériel nécessaire pour prélever puis analyser un échantillon de tissu afin d’être sûr de l’identification d’une espèce, l’identification individuelle est réalisée soit à vue, c’est-à-dire par reconnaissance de caractères morphologiques caractéristiques, soit au chant. Les individus ayant été photographiés, ceux dont l’identification posait problèmes ont pu être examinés par le professeur Nirhy Rabibisoa.
Identification à vue
L’identification à vue est réalisée grâce au guide “A Field Guide to the Amphibians and Reptiles of Madagascar” de Glaw & Vence (3e éd, 2007). Plusieurs paramètres concourent à l’identification des grenouilles, notamment :
– la morphologie
– l’habitat
– les couleurs (dos, flancs, ventre, pattes…) même si ce trait de caractère est parfois trompeur
– Formule palmaire et l’articulation tibio-tarsale (cf. Annexe V)
– Oeil (forme de la pupille, couleur de l’iris…)
– Disposition des sacs vocaux et description des glandes fémorales pour les mâles
Identification au chant
L’identification au chant, bien qu’elle ne permette que de détecter les individus mâles, permet un inventaire de la diversité spécifique et se révèle particulièrement importante dans une zone où la majorité des espèces ne mesure pas plus de 3 cm et se camoufle très bien dans leur environnement. De plus, les grenouilles se retrouvent parfois à plus de 2m au-dessus du sol (Glaw & Vence, 2007) et sont donc non observables, d’où un intérêt supplémentaire de l’identification acoustique.
Celle-ci est réalisée par enregistrement des chants (appareil photo personnel) puis comparaison avec les chants de grenouilles potentiellement présentes dans la réserve. Celles-ci sont déterminées en fonction de la répartition des espèces décrite par Glaw & Vence dans leur guide et à partir de leur présence attestée par l’inventaire biologique de la réserve réalisé en 2005 (Randrianirina & al., 2005). Les chants ont été obtenus par téléchargement depuis la base de données disponible sur le site internet AmphibiaWeb. Il devient alors possible de comparer les chants enregistrés sur le terrain avec les chants de référence.
4) Analyse des données
Remarque : Certaines observations ont été faites en dehors des phases d’inventaire sur site. Celles-ci ont été prises en compte notamment pour déterminer la biodiversité totale de la réserve, mais, du fait qu’elles aient été obtenues en dehors de la méthodologie de transect décrite plus haut, elles n’ont pas été retenues pour le reste des analyses.
Les données obtenues lors de cet inventaire permettent en premier lieu de dresser la liste des espèces que l’on retrouve dans la réserve mais aussi de calculer des indices de diversité, de mettre en évidence des différences potentielles entre sites, de comparer leur degré de similarité et d’associer les espèces aux différents habitats.
Toutefois avant de traiter les données obtenues, il est nécessaire de vérifier que l’échantillonnage ait été suffisant.
a) Effort d’échantillonnage
Afin d’évaluer, de manière générale et sur chaque site, si l’effort d’échantillonnage a été suffisant, une courbe d’accumulation a été réalisée. Cette courbe représente le nombre d’espèces nouvelles observées au cours du temps. Une fois que la courbe montre un plateau, l’échantillonnage est considéré comme suffisant.
b) Diversité des sites
Afin de déterminer les sites que l’on peut considérer comme hotspots et qui serviront donc de sites de référence pour les suivis amphibiens ultérieurs, il est nécessaire de comparer à la fois les critères qualitatifs (diversité spécifique) et quantitatifs (abondance respective des différentes espèces) de chaque site échantillonné.
Pour ce faire, il existe de nombreux indices permettant d’évaluer ces critères et donc de discriminer les sites les plus pertinents pour un suivi sur le long terme. Pour chaque site ont ainsi été calculés : la richesse spécifique, l’indice de Shannon, l’indice de Simpson et l’indice de Hill.
Ces indices ont été calculés à partir du nombre moyen d’individus, de chaque espèce, recensés lors des 3 sessions d’inventaire, soit : le nombre total d’individus observés divisé par le nombre de transects effectués, sauf pour les espèces trouvées uniquement de jour ou uniquement de nuit, pour lesquelles le nombre total d’individus est divisé par le nombre de transects diurnes ou nocturnes selon les cas.
Richesse spécifique
On entend ici par richesse spécifique le nombre total d’espèces recensé sur un site. La richesse spécifique observée est un indice simple, permettant d’illustrer les caractéristiques écologiques d’un milieu. Elle correspond au nombre total d’espèces rencontrées, mais elle ne tient pas compte des abondances relatives. La richesse spécifique observée n’est qu’une approximation du nombre d’espèces réellement présentes et dépend directement de la qualité de l’échantillonnage.
Indice de Shannon
L’indice de Shannon (H’) évalue la diversité au niveau d’un site d’échantillonnage ou d’un habitat. Cet indice est un indicateur de l’équitabilité d’un milieu, il est compris entre 0 et l’infini. Il se calcule de la manière suivante :
H’ = Σ[(ni/N).ln(ni/N]
Avec ni = nombre d’individus de l’espèce i et N = nombre total d’individus
H’ est minimal (=0) si tous les individus du peuplement appartiennent à une seule et même espèce, H’ est également minimal si, dans un peuplement chaque espèce est représentée par un seul individu. L’indice est maximal quand tous les individus sont répartis d’une façon égale sur toutes les espèces (Frontier, 1983 in Grall & Hily, 2003).
C’est la comparaison des indices entre sites qui renseigne sur la plus ou moins grande diversité d’un site. Il est possible de comparer les valeurs de cet indice pour un même site d’une année sur l’autre.
Indice de Simpson
L’indice de Simpson mesure la probabilité que deux individus sélectionnés au hasard dans la population échantillonnée, appartiennent à la même espèce. Cet indice se calcule selon la formule :
D = Σ[ ni.(ni –1)/N.(N-1)]
avec ni = nombre d’individus de l’espèce i et N = nombre total d’individus
D varie entre 0 et 1, 0 représentant le maximum de diversité et 1 le minimum de diversité. Cet indice est d’autant plus faible que le nombre d’espèces est grand (plus il y a d’espèce, plus la probabilité de tirer 2 individus de la même espèce devient faible). Et pour un nombre fixé d’espèces, il est d’autant plus grand que la répartition des fréquences est équitable.
Toutefois, cet indice donne forcément un poids plus important aux espèces abondantes. L’ajout d’espèces rares ne modifie que modérément la valeur de D (Grall & Hily, 2003). De plus cet indice ne permet pas la comparaison d’années en années d’un même site.
Indice de Hill
L’indice de diversité de Hill est une mesure de l’abondance proportionnelle, qui permet d’associer les indices de Shannon et Simpson. L’équation de cet indice est :
Hill = (1/D)/eH’
1/D = inverse de l’indice de Simpson et eH’= exponentielle de l’indice de Shannon
C’est l’indice de Hill qui semble le plus pertinent dans la mesure où il intègre les deux autres indices. Toutefois, il peut être utile d’utiliser les trois indices conjointement afin d’en extraire un maximum d’informations et de mieux comprendre la structure des communautés (Grall & Hily, 2003).
Cependant dans la mesure où l’indice de Shannon est le seul qui puisse permettre la comparaison au cours du temps (nécessaire pour un suivi sur le long terme), il est celui qui nous intéresse le plus et il est donc nécessaire de le calculer. De plus, lorsqu’il n’y a qu’une espèce sur un site, les indices de Simpson et de Hill ne peuvent être calculés. De ce fait, pour la suite de l’analyse, ce seront les indices de Shannon qui seront comparés.
Les indices de chaque site sont calculés avec le logiciel de statistique R (version 2.7.2).
Comparaison inter-sites des indices de diversité
Zones incendiées vs zones intactes
On cherche ici à savoir si il existe une différence significative, en terme de diversité, entre la moyenne des valeurs des indices de Shannon des zones incendiée et celle des zone intactes. On entend par zone incendiée une zone ayant subi les ravages de l’incendie de 2002, ces sites sont représentés par les zones de savane et zones dégradées. A l’inverse, on note zone intacte les sites n’ayant pas été détruits lors de cet incendie.
Afin de déterminer s’il existe une différence significative, une comparaison des intervalles de confiance de la moyenne est effectuée. Puis afin d’évaluer précisément la probabilité qu’une différence (si elle existe) aussi grande puisse être due au hasard (p-value), un test de comparaison de moyenne est réalisé (test d’hypotèse). En l’occurence, comme la moyenne (μ) des indices pour la zone incendiée est égale à zéro avec un écart-type (σ) nul, on utilisera le test de comparaison d’une constante à une moyenne, dont la statistique se calcule de la manière suivante :
e = (μ – a)/√ (s²/n)
avec s² = [ Σ (xi – μ)² ] / (n – 1)
μ = moyenne des H’ des zones intactes
a = constante
s² = estimation de la variance de la population
n = taille de l’échantillon (nombre de H’)
Hypothèse nulle : H0 = Il n’y a pas de différence significative entre 0 et la moyenne des indices de Shannon des zones intactes (les différences observées sont dues uniquement aux fluctuations d’échantillonnage).
Hypothèse alternative : HA = La moyenne des indices de Shannon des zones intactes est significativement différente de 0
La normalité de la distribution des données est vérifiée par le test de Shapiro-Wilk réalisé à l’aide du logiciel R. Les intervalles de confiance ont également été calculés avec ce logiciel.
Zone de collecte vs zone non exploitée
On cherche à savoir si la différence entre les indices de Shannon du site 3 et du site 6 est significative. Ceci revient à voir si la diversité de la forêt littorale marécageuse de niaouli exploitée est significativement différente de celle de la forêt littorale marécageuse de niaouli non exploitée.
Il est possible d’évaluer une différence significative entre deux indices de Shannon grâce à un test t de student modifié (Jayaraman, 1999). En réalité, la modification porte sur l’estimation de la variance qui est adaptée à l’indice de Shannon. On a alors :
t = | H’1 – H’2 |/√(Var H’1 + Var H’2)
avec Var (H’) = [Σ pi.ln(pi) – Σ[pi.ln(pi)]²]/N + [(S – 1)/(2N)²]
t = statistique du test
H’1 et H’2 = Indices de Shannon des sites à comparer
pi = ni / N où ni : nombre d’individus de l’espèce i et N : nombre total d’individus
S = nombre d’espèces observées
Le calcul du nombre de degrés de liberté s’effectue selon la formule suivante :
Les hypothèses du test sont :
H0 = Il n’y a pas de différence significative de diversité entre les 2 sites
HA = Il existe une différence significative de diversité entre les 2 sites
c) Similarité des sites
Un autre facteur étudié est la similarité des sites entre eux. Ce paramètre est estimé grâce à l’indice de Jaccard (Sj) qui permet de comparer entre 2 sites le nombre d’espèces communes par rapport au total des espèces recensées. Cet indice se calcule comme suit :
Sj=c/(a+b-c)
c = nombre d’espèces communes
a = espèces du site a
b = espèces du site b
Cet indice varie entre 0 et 1. Il prend la valeur 0 lorsque les deux transects n’ont aucune similarité (aucune espèce en commun) et 1 lorsque la similarité est maximale (toutes les espèces sont en commun).
A partir des indices de Jaccard obtenus pour chaque paire de site, il est possible de créer une matrice de distance. Cette matrice illustre la dissimilarité des sites entre eux (distance = 1 – Sj) et permet alors d’obtenir un dendrogramme regroupant les sites en fonction de leur plus ou moins grande similarité.
Le calcul des indices de Jaccard, la matrice de distance ainsi que le dendrogramme sont obtenus grâce au logiciel R.