I.2.1. Définition :
Un métal est une matière, issue le plus souvent d’un minerai ou d’un autre métal, dotée d’un éclat particulier, bon conducteur de chaleur et d’électricité, ayant des caractéristiques de dureté et de malléabilité, se combinant ainsi aisément avec d’autres éléments pour former des alliages utilisables dans l’industrie.(Gérard M, 2001).
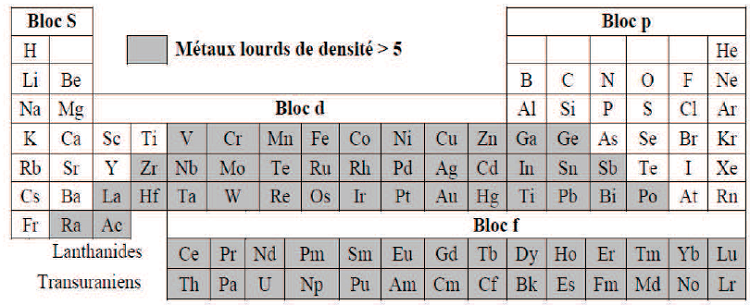
On appelle en général métaux lourds les éléments métalliques naturels, de densité supérieure à 5 g/cm3 et tout métal ayant un numéro atomique élevé, en général supérieur à celui du sodium (Z=11).Les métaux lourds montrés dans le tableau I.1, sont présents dans tous les compartiments de l’environnement, mais en général en quantités très faibles sous forme de traces. Il s’agit de tous les éléments de transition possédant une orbital d’insaturée, y compris les lanthanides et les actindes (bloc d et f de la classification de Mendeleïev), à l’exception du scandium, du titane et de l’ytrium. On classe de même parmi les métaux lourds, les éléments intermédiaires les moins électronégatifs du bloc p, parmi lesquels figurent le plomb et l’étain (Fourest E,1993).
Tableau I.1 : Classification périodique des éléments.(Fourest E, 1993)
(Niebœr et Richardson, 1980) ont proposé une nouvelle classification des éléments, basée sur des propriétés de complexation. Ils distinguent trois classes d’éléments :
Classe A : regroupe des éléments qui ont une affinité pour des ligands contenant des atomes d’oxygène.
Classe B : regroupe des éléments qui ont une affinité pour des ligands contenant des atomes d’azote et du soufr
Classe C (intermédiaire) : regroupe des éléments ayant une affinité à la fois pour l’oxygène, l’azote et le soufre.
Les métaux les plus souvent impliqués dans la pollution, appartiennent aux classe B et intermédiaire, comme Hg2+, Ag2+, Pb2+, Cu2+, Ni2+, Zn2+, Cd2+. Les métaux de la classe intermédiaire peuvent interagir avec tous les groupements fonctionnels L’intérêt de ce type de classification est qu’elle permet de prévoir les sites de fixation potentiels des métaux au sein du matériel biologique.
I.2.2. Caractéristiques des métaux :
I.2.2.1 Propriétés physico-chimiques des métaux lourds :
Les métaux lourds possèdent les propriétés physiques générales des métaux (bonne conductivité thermique et électrique). Ils sont fortement électropositifs et donnent par perte d’électrons des cations métalliques de charge variable. Ces cations métalliques, qui présentent à la fois des densités de charge élevées et un caractère électrophile, peuvent former avec des ligands des liaisons ioniques, covalentes ou intermédiaires, et donnent naissance à des complexes plus ou moins stables (Diard P, 1996).
I.2.2.2 Importances physiologiques des métaux :
Certains éléments du tableau périodiques, sont nécessaires aux organismes vivants en faible quantité : Zn, Cu, Mn, Ni, Fe, B, Co et Se sont des oligo-éléments nécessaires à la nutrition des plantes. Ils interviennent également dans les réactions métaboliques, ou dans des réactions biochimiques telles que l’oxydoréduction ou l’hydrolyse. Les oligo-éléments sont généralement présents dans l’eau et aliments. Leur absence peut entraîner des carences.
Cependant, l’augmentation de la concentration de ces éléments est nocive pour les organismes vivants. D’autre éléments comme le cadmium, le plomb, le mercure, etc.… ne sont pas essentiales pour les organismes vivants et ne produisent que les effets toxiques (Mirghffari N, 1998).
I.2.2.3 Toxicité des métaux lourds :
La toxicité des métaux lourds est due essentiellement à :
• Leur non-dégradabilité.
• Leur toxicité à faible concentration.
• Leur tendance à s’accumuler dans les organismes vivants et à se concentrer le long des chaines trophiques.
La toxicité d’un élément métallique dans l’environnement dépend de la forme chimique sous laquelle il existe. On peut citer comme exemple, le cas du Mn² et de l’As qui sont plus toxiques que le IIMn et l’As²(Geldmacher-von., et al 1991).L’une des caractéristiques de la toxicité des métaux est leur pouvoir de former des ligands (Morgan J., et al, 1991).La disponibilité et la toxicité dépendent de la concentration des ions libres de l’élément, ainsi que de la concentration totale du métal ou de celle du complexe du métal.