Le diabète sucré s’accompagne d’un stress oxydant et d’une production de radicaux libres par divers mécanismes. Ce stress oxydant se trouve impliqué dans l’aggravation de la maladie ainsi que dans l’apparition des complications chroniques liés au diabète.
3.1. Définition du stress Oxydant
Des espèces réactives de l’oxygène (ERO), parmi elles les radicaux libres, sont produites en permanence par notre organisme (rôle physiologique) mais un système efficace de défenses antioxydantes (vitamines, enzymes, oligoéléments) permet de réguler cette production afin de prévenir tout dégât cellulaire excessif [Pincemail et al., 2002]. Le stress oxydant se définit comme étant un déséquilibre profond de la balance entre les pros oxydants (ERO) et les antioxydants en faveur des premiers, ce qui conduit à des dégâts cellulaires irréversibles. [Favier., 2003]
3.2. Les Espèces réactives de l’oxygène (ERO)
Les espèces réactives de l’oxygène et les radicaux libres sont des entités chimiques, molécules, morceaux de molécule, ou simple atomes possédant un ou plusieurs électrons célibataires (électrons non apparié sur une orbitale), ce qui leurs confèrent une grande réactivité. En effet, ce radical libre aura toujours tendance à remplir son orbitale en captant un é1ectron pour devenir plus stable : il va donc se réduire en oxydant un autre composé (Système redox) [Goudable et al., 1997]
Les principales ERO entrant dans les processus physiopathologiques humains sont regroupés dans le tableau II :
Tableau II : Les principales espèces réactives de l’oxygène
3.3. Quelle est l’origine de ces entités chimiques oxydantes ?
La production des ERO dans les cellules humaines est essentiellement d’origine enzymatique [Beaudeux., 2006] et résulte de plusieurs mécanismes :
3.3.1. Chaine Respiratoire Mitochondriale
La mitochondrie représente le site majeur de production cellulaire d’ERO : dans les cellules non phagocytaires 80 % de l’anion superoxyde proviennent du fonctionnement de la chaîne respiratoire [Carrière et al., 2006]. En effet une proportion significative de l’oxygène (2 à 3 %) échappe à la réduction complète en H2O et subit une réduction monoélectronique au niveau des complexes I et III de la chaîne respiratoire pour donner naissance à l’anion superoxyde (O2-), qui est le précurseur des ERO [Gardès -Albert et al., 2003].
3.3.2. Les phagocytes
La phagocytose des bactéries et parasites par les macrophages ou les polynucléaires s’accompagne d’une production d’ERO connue sous le nom d’explosion respiratoire (cf. figure 7) [Favier., 2003]. Au sein du phagosome, l’activation de la NADPH oxydase va donner lieu à la production de l’anion superoxyde (O2-) qui sera dismuter (H2O2) grâce l’action des superoxydes dismutases (SOD), le peroxyde d’hydrogène en présence de l’ion ferreux va former le radical hydroxyle (OH-) puissant agent oxydant. De plus les phagocytes possèdent des granulations qui vont libérer la Myeloperoxydase qui en présence de chlore et de l’anion superoxyde va catalyser la formation de l’acide hypochloreux HOCl [Pasquier., 1995].
Figure 7 : Métabolisme oxydatif du neutrophile [Reeves., 2002]
3.3.3. L’environnement
Des facteurs environnementaux peuvent contribuer à la formation d’entités radicalaires. Une production importante d’ERO est observée lors d’une intoxication par des métaux lourds (cadmium, mercure, arsenic) ou dans les phénomènes d’irradiations provoquant des dommages au niveau de l’ADN. Par ailleurs la fumée de tabac, l’alcool ou même certains médicaments (Xénobiotiques) peuvent être source de radicaux libres par oxydations de ces composés au niveau du cytochrome P450 [Favier., 2003].
3.4. Importance physiologique des espèces réactives de l’oxygène : le paradoxe
Le paradoxe des radicaux libres c’est qu’ils constituent des espèces extrêmement dangereuses, susceptibles d’engendrer un nombre considérable de maladies, tout en étant des espèces indispensables à la vie [Favier., 2003]. Ils remplissent en effet de très nombreuses fonctions :
3.4.1. Destruction de microorganismes
Comme nous l’avons vu précédemment, les cellules immunitaires sont sources d’ERO, elles sont produites en réponse à différents stimuli, en particulier des pathogène et jouent un rôle majeur dans la destruction des agents microbiens [Elbim C., 2003].
3.4.2. Messagers cellulaires
Si la production des ERO est relativement modérés, ils peuvent jouées un rôle de messager intra et/ou extracellulaire [Favier., 2003]. Ils sont ainsi impliqués dans les phénomènes d’apoptose (mort cellulaire programmée), dans la prolifération des cellules musculaires lisses (cellules vasculaires), dans l’adhésion des monocytes aux cellules endothéliales, ou bien encore dans l’agrégation plaquettaire [Gardès-Albert et al., 2003], et permettent aussi l’expression de gènes de défense. [Favier., 2003].
3.4.3. Régulation du tonus vasculaire
Le NO, par stimulation de la guanylate cyclase soluble, permet la formation et l’augmentation de la concentration du GMPc dans le muscle lisse. Le GMPc active une série de protéines kinases, déclenchant ainsi une cascade de réaction qui aboutissent à une vasodilatation artérielle et veineuse [Sabry et al., 1996].
3.5. Les molécules biologiques : cibles des radicaux libres
La production excessive de radicaux libres provoque des lésions directes de molécules biologiques (oxydation de l’ADN, des protéines, des lipides) [Favier., 2003].
3.5.1. La peroxydation lipidique
La peroxydation des lipides résulte de l’attaque par des radicaux libres des acides gras polyinsaturés (acide linoléique, linolénique, arachidonique). Cette réaction est à l’origine de dommages tissulaires responsables de cancers, de maladies inflammatoires, du vieillissement et de lésions vasculaires comme l’athérosclérose. [Raccah., 2004].
Le radical hydroxyle capable d’arracher un hydrogène sur les carbones situés entre deux doubles liaisons (cf. figure 8), pour former un radical diène conjugué, qui en présence d’oxygène va être oxydé en radical peroxyle. C’est l’étape d’initiation [Hennebelle et al., 2004].
Figure 8 : Initiation de la peroxydation lipidique [Favier., 2003]
Cette réaction appelée peroxydation lipidique forme une réaction en chaîne, car le radical peroxyle formé va s’attaquer à un acide gras voisin et se transformer en hydroperoxydes tandis que le 2eme acide gras rentre dans le même circuit de peroxydation pour former un nouveau radical diène conjugué qui sera oxydé par l’oxygène pour former le 2eme radical peroxyl qui s’attaquera au 3eme acide gras conduisant à une réaction en chaine (cf. Figure 9) C’est la propagation. [Favier., 2003]
Figure 9 : La propagation de la peroxydation lipidique à d’autres AGPI : réaction en chaine [Favier.,2003]
Une partie des hydroperoxydes formés vont être réduit et neutraliser par le glutathion peroxydases, Les hydroperoxydes non réduits vont se décomposer facilement en différents produits, les plus étudiés sont les aldéhydes : malondialdéhyde (MDA), l’hydroxynonenal et les isoprostanes (cf. Figure 10) [Therond., 2006]
Figure 10 : Produits terminaux de la peroxydation lipidique [Favier., 2003]
Le MDA fait partie des aldéhydes réactifs issus de la décomposition des hydroperoxydes. En raison de son caractère mutagène et athérogène, il est le produit le plus étudié de la dégradation des hydroperoxydes [Flourie., 2006], il est considéré comme ayan une implication dans l’initiation des cancers. [Cadet J., 1997].
Cette attaque des lipides peut concerner les lipoprotéines circulantes (oxydation des LDL) ou les phospholipides membranaires et elle est très dommageable pour les cellules tant au niveau de leur fonction que sur les propriétés de leurs membranes: altération de la fluidité membranaire, augmentation de leur perméabilité, diminution du potentiel de membrane, voire rupture. [Raccah., 2004]
3.5.2. Les Protéines
Les ERO sont en effet capables de réagir avec différents acides aminés des chaînes de protéines, altérant également leur fonction. L’oxydation de ces acides aminés conduit à une modification de la conformation spatiale et à une altération de la fonction protéique. Les protéines oxydées perdent leur capacité à se fixer correctement sur un récepteur ou à fixer spécifiquement un ligand, altérant la signalisation cellulaire [Koechlin-Ramonatxo., 2006].
3.5.3. Les Acides Nucléiques
Les radicaux O2-° et OH-° provoquent des lésions de l’ADN. Ceux-ci peuvent interagir avec les désoxyriboses de l’ADN mais aussi avec ses bases puriques et pyrimidiques [Therond., 2006]. Les produits secondaires de la peroxydation des acides gras polyinsaturés tel que le MDA (aldéhydes mutagènes) peuvent interagir avec l’ADN et formé des adduits [Favier., 2003]. Ces altérations structurales lorsqu’elles ne sont pas réparées entraînent à long terme des altérations géniques [Koechlin-Ramonatxo., 2006]
3.6. Moyens de lutte contre les radicaux libres : les antioxydants
Les antioxydants sont définis comme l’ensemble des molécules susceptibles d’inhiber directement à faibles doses la production, de limiter la propagation ou de détruire les ERO [Favier. A, 2003]. Les systèmes antioxydants peuvent être divisés en deux catégories : les antioxydants enzymatiques et les antioxydants non enzymatiques :
3.6.1. Les Antioxydants Enzymatiques
L’organisme dispose d’un arsenal important d’enzymes antioxydantes ubiquitaires [Afonso V., 2007] :
a. Les superoxydes dismutases (SOD)
Les SOD sont des métalloprotéines [Ghisolfi-Marque et al., 2006], qui permettent l’élimination des anions superoxydes (O2-°) ou tout au moins de les maintenir à un niveau de concentration assez bas, par dismutation en peroxyde d’hydrogène (H2O2) et en une molécule d’oxygène (O2) [Gardès-Albert., 2003]
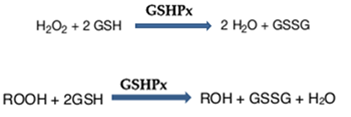
b. La glutathion peroxydase (GSHPx) :
La GSHPx est localisée dans les milieux extracellulaires, le cytosol et les mitochondries [Ghisolfi-Marque., 2006]. Ces enzymes réduisent le peroxyde d’hydrogène et les hydroperoxydes lipidiques en utilisant le glutathion réduit (GSH) sur lequel elles transfèrent l’oxygène, le transformant en glutathion oxydé (GSSG) [Goudable et al., 1997]
c. La Catalase (CAT)
La catalase est une enzyme qui contient du fer. Elle est concentrée dans le foie et les érythrocytes [Tessier et al., 1995]. Elle réduit le peroxyde d’hydrogène en libérant de l’oxygène et de l’eau et leurs rôles est très important surtout en présence d’ions ferreux en permettant d’éliminer l’excès de peroxyde d’hydrogène afin que la réaction de Fenton ne puisse pas s’amplifier [Goudable et al., 1997].
3.6.2. Les Antioxydants non enzymatiques
Les antioxydants non enzymatiques comprennent des molécules qui sont apportés par l’alimentation (exogènes) et autres molécules dont dispose l’organisme (endogènes).
Parmi les antioxydants apportés par l’alimentation on retrouve la vitamine E, une substance liposoluble antioxydante majeure [Tessier et al., 1995] qui agit par rupture de la réaction en chaine (peroxydation lipidique) au niveau des membranes cellulaires [Lecerf et al., 1994]. D’autres vitamines jouent un rôle d’agents réducteurs : la vitamine C [Pincemail. et al., 2002] ainsi que Le β Carotène précurseur de la vitamine A et qui à les mêmes fonctions que la vitamine E [Lecerf et al., 1994]. Les micronutriments sont aussi des éléments indispensables à l’activité d’enzymes antioxydantes tels que les superoxydes dismutases pour lesquels le zinc joue un rôle structurale et le cuivre un rôle antioxydant [Favier., 2003].
On ce qui concerne les antioxydants endogènes on retrouve le glutathion qui est un tri peptide et qui possède une fonction thiol qui lui confère un rôle d’antioxydant qu’il exerce vis-à-vis de nombreuses espèces oxydantes [Gardes-Albert., 2003]. Le fer et le cuivre sous forme libre étant promoteurs de dommages radicalaires, ces métaux sont séquestrés et transportés grâce à des protéines comme la ferritine, la transférine ou la céruloplasmine [Fontaine., 2007].
L’albumine aussi joue un rôle d’antioxydant grâce à sa cystéine en position 34 qui permet de capturer les ERO [Mira., 2008]. L’acide urique est aussi connu pour être un antioxydant [Izzedine et al., 2011].
Figure 11 : Régulation des ERO par les antioxydants [Pincemail et al., 2002]
3.6.3. Les antioxydants d’origine végétale : les flavonoïdes
Les flavonoïdes sont des produits largement distribués dans le règne végétal et sont couramment consommés sous forme de fruits, légumes et boissons tel le thé. Ils sont capables de moduler l’activité de certaines enzymes et de modifier le comportement de plusieurs systèmes cellulaires, suggérant qu’ils pourraient exercer une multitude d’activités biologiques, notamment des propriétés antioxydantes [Ghedira, 2005]. En effet les flavonoïdes inactivent et stabilisent les radicaux libres grâce à leur groupement hydroxyle fortement réactif et ils sont également capables de chélater les ions métalliques oxydants [Derbel et al., 2005].
3.7. Mécanismes impliqués dans la genèse d’un stress oxydant dans le diabète
Dans des conditions d’hyperglycémie chronique, plusieurs mécanismes peuvent être responsables de la production de radicaux libres :
3.7.1. La voie des Polyols
En présence d’un excès de glucose, une fraction non oxydée de ce substrat est dirigée vers la voie des polyols : sous l’effet de l’aldose réductase, le glucose est réduit en sorbitol par le NADPH (cf. figure 12). Le sorbitol est ensuite oxydé en fructose en présence de NAD+ par la sorbitol-déshydrogénase [Raccah., 2004]. Cette voie va conduire à une déplétion intracellulaire de NADPH puisque le NADPH est nécessaire à l’activité de l’aldose réductase.
Le déficit intracellulaire de NADPH a pour conséquence une faible régénération du glutathion réduit à partir du glutathion oxydé. [Bonnefont-Rousselot., 2004]
Figure 12 : Déplétion du glutathion par la voie des polyols [Bonnefont-Rousselot., 2004]
3.7.2. Glycosylation non enzymatiques des protéines : la glycation
La glycation des protéines est une réaction covalente qui attache, sans l’intervention d’enzyme, des résidus glucose aux NH2 libres des protéines [Raccah., 2004]. L’étape initiale de cette réaction se caractérise par la formation non enzymatique d’une liaison covalente entre le groupement carbonyle d’un sucre réducteur et le groupement amine libre d’un acide aminé.
Elle conduit à la formation d’une base de Schiff, qui peut subir des réarrangements intramoléculaires (réarrangements d’Amadori), pour former des composés dicarbonylés. La déshydratation et/ou la condensation de ces composés donnent alors naissance aux produits de fin de glycation AGE (advanced glycation end products) [Guillet C., 2010].
Ces AGE forment un groupe hétérogène de molécules qui modifient non seulement la fonction de la protéine glyquée mais forment aussi des agents qui se lient à d’autres protéines, tel le collagène et autres protéines de la matrice extracellulaire dont les fonctions se trouvent ainsi altérées avec des conséquences délétères sur les tissus vasculaires, cardiaques et rénaux [Dali-Youcef., 2010]. Les AGE sont capables aussi de produire des radicaux libres oxygénés par interaction avec des récepteurs spécifiques (RAGE) et induire un stress oxydant [Bonnefont-Rousselot., 2004].
3.7.3. L a mitochondrie
La chaine respiratoire mitochondriale est le principal site de production de l’anion superoxyde, cette production est accrue en présence de fortes concentrations de glucose [Bonnefont-Rousselot., 2004].
A coté des ces 3 voies, d’autres mécanismes peuvent être la source d’un stress oxydant dans le diabète comme : l’auto-oxydation du glucose et l’activation de la NADPH oxydase vasculaire. [Bonnefont-Rousselot., 2004].
3.8. Impact du stress oxydant sur les cellules β et sur l’action de l’insuline
Le rôle pathogène des radicaux libres sur les cellules β a souvent été évoqué car ces cellules ont des défenses limitées face au stress oxydant [Rigalleau et al., 2007]. En effet les espèces réactives de l’oxygène perturbe la sécrétion de l’insuline stimulée par le glucose par la diminution du rapport ATP/ADP intracytosolique, par l’hyperpolarisation anormale de la membrane mitochondriale et une surexpression du complexe І de la chaine respiratoire se qui conduit à l’apoptose des cellules β et pourrait expliquer la réduction de la masse des cellules β observée dans le DT2 [Guillausseau et al., 2008]. Et selon certains auteurs [Bonnefont-Rousselot., 2004] ces radicaux libres pourrait être aussi à l’origine du diabète de type 1.
Il semble aussi que les radicaux libres produits excessivement et insuffisamment dégradés au cours du diabète, participe dans l’instauration et l’aggravation de l’insulinorésistance par activation de voies de signalisation qui mènent à l’inhibition de la cascade de signalisation de l’insuline [Barquissau. V et al, 2011].
Figure 13 : Relation entre hyperglycémie et stress oxydant [Bonnefont-Rousselot., 2004]
Page suivante : 4. Les complications chroniques liées au diabète


![Métabolisme oxydatif du neutrophile [Reeves., 2002]](https://www.institut-numerique.org/wp-content/uploads/2013/10/Métabolisme-oxydatif-du-neutrophile-Reeves.-2002.png)
![Initiation de la peroxydation lipidique [Favier., 2003] Initiation de la peroxydation lipidique [Favier., 2003]](https://www.institut-numerique.org/wp-content/uploads/2013/10/Initiation-de-la-peroxydation-lipidique-Favier.-2003.png)
![La propagation de la peroxydation lipidique à d’autres AGPI réaction en chaine [Favier., 2003] La propagation de la peroxydation lipidique à d’autres AGPI réaction en chaine [Favier., 2003]](https://www.institut-numerique.org/wp-content/uploads/2013/10/La-propagation-de-la-peroxydation-lipidique-à-d’autres-AGPI-réaction-en-chaine-Favier.-2003.png)
![Produits terminaux de la peroxydation lipidique [Favier., 2003] Produits terminaux de la peroxydation lipidique [Favier., 2003]](https://www.institut-numerique.org/wp-content/uploads/2013/10/Produits-terminaux-de-la-peroxydation-lipidique-Favier.-2003.png)
![Régulation des ERO par les antioxydants [Pincemail et al., 2002]](https://www.institut-numerique.org/wp-content/uploads/2013/10/Régulation-des-ERO-par-les-antioxydants-Pincemail-et-al.-2002.png)
![Déplétion du glutathion par la voie des polyols [Bonnefont-Rousselot., 2004] Déplétion du glutathion par la voie des polyols [Bonnefont-Rousselot., 2004]](https://www.institut-numerique.org/wp-content/uploads/2013/10/Déplétion-du-glutathion-par-la-voie-des-polyols-Bonnefont-Rousselot.-2004.png)
![Relation entre hyperglycémie et stress oxydant [Bonnefont-Rousselot., 2004] Relation entre hyperglycémie et stress oxydant [Bonnefont-Rousselot., 2004]](https://www.institut-numerique.org/wp-content/uploads/2013/10/Relation-entre-hyperglycémie-et-stress-oxydant-Bonnefont-Rousselot.-2004.png)