2.1. Définition
Le diabète sucré est aujourd’hui considérée comme une maladie dégénérative majeure dans le monde, menaçant d’une manière croissante, la santé publique [Saha et al., 2012].
L’OMS définit le diabète comme une hyperglycémie chronique caractérisé par une perturbation du métabolisme des hydrates de carbone, des lipides et des protéines, et résultant d’un défaut de la sécrétion d’insuline, de l’action de l’insuline, ou de leurs associations.
Cette hyperglycémie chronique liée au diabète est associée à d’importantes séquelles à long terme, particulièrement à des lésions, des anomalies et une insuffisance de divers organes, surtout les reins, les yeux, les nerfs, le coeur et les vaisseaux sanguins [Saha et al., 2012].
2.2. Prévalence mondiale
Au niveau mondial, le diabète, et notamment le diabète de type 2 (DT 2), touche 5,9 % de la population adulte, pour 80 %, les patients habitent des pays émergents. Le nombre de personnes atteintes de diabètes est en augmentation considérable, passant de 135 millions en 1995 à 171 millions en 2000, à 246 millions en 2007 et atteindrait les 380 millions en 2025 [Lefebvre., 2008].
2.3. Critères diagnostiques du diabète
Les critères diagnostiques de références sont ceux de l’OMS et sont basés sur la détermination de la glycémie à jeun ou 2 heures après une charge orale en glucose (épreuve d’hyperglycémie provoqué par voie orale ou HGPO). Le diagnostic du diabète peut être établi de trois façons [Drouin et al., 1999] :
– Glycémie quelle que soit l’heure ≥ 2,00 g/L (11,1 mmole/L) et symptômes de diabète (polyurie, polydipsie, amaigrissement inexpliqué),
– Glycémie à jeun ≥ 1,26 g/L (7,00 mmole/L) pratiqué deux foies.
– Glycémie 2 h après une charge de 75 g de glucose lors d’une hyperglycémie provoquée par voie orale ≥ 2,00 g/L (11,1 mmole/L).
2.4. Classification étiologiques des diabètes sucrés
La classification du diabète proposés par l’OMS tient compte à la fois de l’étiologie de la pathologie diabétique et de la nécessité vitale ou non du traitement insulinique et il faut noter que les termes diabète insulinodépendant et diabète non insulinodépendant ne sont plus utilisés et sont remplacés respectivement par diabète type 1 et diabète type 2. [Tournant et al., 1998].
Le diabète sucré est divisé en 4 classes qui sont représentés dans le tableau І cidessous :
Tableau І : classification étiologique des diabètes sucrés
2.5. Diabète de type 1
Cette forme de diabète est la conséquence d’une destruction des cellules β des îlots de Langerhans par un processus auto-immun à médiation cellulaire, survenant sur un terrain génétique de susceptibilité et conduisant à une carence absolue en insuline [Dubois-Laforgue., 2007].
2.5.1. Aspects cliniques
Le DT 1 auto-immun peut survenir à n’importe quel âge, avec une incidence maximale entre 10 et 14 ans, néanmoins dans la moitié des cas il est diagnostiqué après l’âge de 20 ans. [Dubois-Laforgue,. 2007]. La rapidité de destruction des cellules β pancréatiques est variable selon les individus [Tournant et al., 1998]. Chez l’enfant le début est brutal avec syndrome polyuropolydipsique, altération de l’état général, amaigrissement, polyphagie et une cétose qui est présente lors du diagnostic dans 85 % des cas tandis que chez l’adulte les symptômes sont moins bruyants et l’acidocétose inaugurale est rare [Dubois-Laforgue., 2007].
2.5.2. Aspects éthiopathogéniques
a. Immunologie du diabète type 1
Le DT1 résulte de la destruction des cellules β par un processus auto-immun à médiation cellulaire dont le quel ne participent pas nécessairement les auto-anticorps retrouvés chez les sujets diabétiques et pré diabétiques de type 1. Ces auto-anticorps sont dirigés vers des auto-antigènes des cellules β pancréatiques et on peut citer [Tournant et al., 1998] :
– Les auto-anticorps anti cellules d’ilots ou ICA
– Les auto-anticorps anti décarboxylase de l’acide glutamique ou GAD
– Les auto-anticorps anti insuline ou IAA
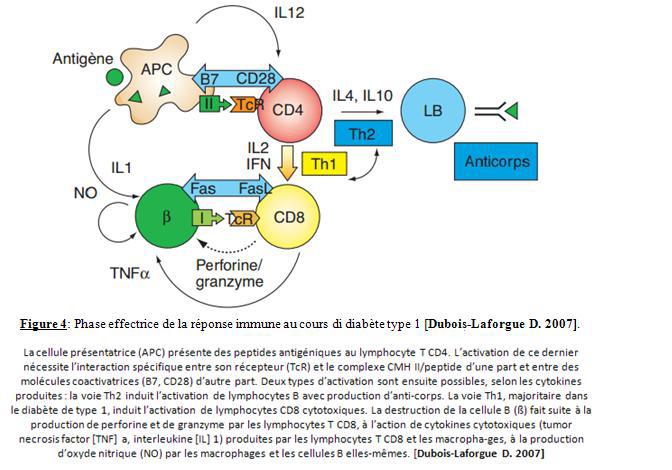
La destruction des ilots β dans les quelles les mécanismes cellulaire occupent une place prépondérante se déroule en 3 phases : présentation du ou des auto-antigènes par des macrophages, activation des lymphocytes T helper CD4+ qui se regroupent autour des ilots de Langerhans et le recrutement tardifs des lymphocytes T cytotoxiques CD8+ avec infiltrat lymphocytaire à l’intérieur des ilots et destruction des cellules insulinosecestrices [Dubois-Laforgue., 2007]. Les différentes étapes de la réaction immunitaire ainsi que les mécanismes moléculaires intervenant dans cette réaction sont décrites dans la figure 4 ci-dessous :
b. L’environnement
Plusieurs facteurs environnementaux ont été incriminés comme pouvant favoriser le déclenchement de la maladie diabétique. Parmi ces facteurs on trouve les agents infectieux surtout virales (virus de la rubéole, le coxsackie virus) qui pourrait favoriser l’expression des auto-antigènes pancréatiques et les protéines de lait de vache qui peuvent causés une immunisation précoce contre l’albumine bovine qui présente une séquence commune avec une protéine d’ilot [Tournant et al., 1998].
2.6. Diabète de type 2 :
Le diabète de type 2, dont plus des 90% des patients diabétiques sont atteints [Lefèbvre. P, 2008] est une maladie multifactorielle, où se conjuguent des facteurs héréditaires et des facteurs liés à l’environnement en particulier le surpoids et la sédentarité. Cette maladie associe deux anomalies métaboliques dont l’importance relative est variable d’une forme à l’autre : un déficit de l’insulinosécrétion ou insulinopénie, et une diminution de la sensibilité à l’insuline des tissus cibles (insulinorésistance). La combinaison des deux anomalies conduit au DT2. [Guillausseau et al., 2003].
2.6.1. Aspects cliniques :
Une des caractéristiques cliniques du diabète de type 2 est la fréquence avec le quelle il peut resté méconnu pendant des années chez un patient qui est asymptomatique tant que l’hyperglycémie reste modérée, Le plus souvent, le diagnostic est donc posé devant une hyperglycémie constatée lors d’un examen biologique systématique chez un malade qui présente le plus souvent des facteurs de risques d’apparition d’un diabète de type 2. [Tournant et al., 1998].
Parmi ces facteurs de risques on retrouve : l’obésité (IMC ≥ 30), l’âge (40 ans et plus), parents du premier degré atteint de diabète de type 2, présence de complications associées audiabète, maladie vasculaire (coronarienne, cérébrovasculaire ou périphérique), hypertension artérielle, dyslipidémie, antécédent(s) de diabète gestationnel ou de macrosomie foetale chez une femme [Ur., 2008].
2.6.2. Physiopathologie du DT2 :
Selon la définition de l’OMS, le diabète type 2 associe deux anomalies métaboliques dont l’importance relative est variable d’une forme à l’autre : un déficit de l’insulinosécrétion ou insulinopénie, et une diminution de la sensibilité à l’insuline des tissus cibles appelée insulinorésistance. [Guillausseau et al., 2003].
a. L’insulinorésistance : rôle de l’obésité
L’insulinorésistance se définit comme une réduction de la capacité de l’insuline à stimuler le métabolisme de ses tissus cible en particulier le foie, les muscles squelettiques et le tissus adipeux [Girard., 2008]. Au niveau tissulaire, la perte d’efficacité de l’insuline se traduit par une moindre inhibition de la production hépatique de glucose (pas de freination de la gluconéogenèse hépatique), par une moindre inhibition de la lipolyse dans le tissu adipeux et
par une diminution de la captation de glucose par le muscle squelettique [Barquissau et al.,2011].
Parmi les facteurs majorants l’insulinoresistance musculaire et hépatique, on retrouve l’obésité en particulier si l’excès de masse grasse est androïde ou abdominal, cette obésité est favorisée par un mode de vie sédentaire et une alimentation hyperlipidique [Guillausseau et al., 2003]. En fait l’excès du tissu graisseux et la non inhibition de la lipolyse par l’insuline vont conduire à une augmentation de la concentration plasmatique des acides gras non estérifiés et un afflux de ces AGL au niveau du foie et du muscle supérieure aux capacités d’oxydation se qui engendrera une accumulation de métabolites intermédiaires des acides gras comme les acyl-CoA à longues chaînes, les diacylglycérols (DAGs) et les céramides. Ces métabolites lipidiques sont capables de provoquer des désordres sur le métabolisme du glucose dans les cellules musculaires et hépatiques en perturbant la voie de signalisation de l’insuline, en diminuant la captation de glucose ainsi que la synthèse de glycogène en réponse à l’insuline [Barquissau et al., 2011]. Le tissu adipeux des diabétiques de type 2 sécrète aussi d’avantage d’adipocytokines (TNF- α, interleukine 6) qui inhibent la voie de signalisation de l’insuline [Rigalleau et al., 2007]. L’ensemble des de ces dommages provoqués par ces métabolites et ces cytokines sécrétés par le tissu adipeux sont appelé : lipotoxicité, et représente l’un des mécanismes impliqué dans l’insulinorésistance [Barquissau et al., 2011].
La diminution de l’action de l’insuline sur ses tissus cibles n’est pas responsable d’un diabète si elle est isolée. [Guillausseau et al., 2003] c’est pour sa qu’elle est toujours associé à une altération de l’insulinosécrétion dans le diabète type 2.
b. Altération de l’insulinosecrétion :
Un déficit de l’insulinosécrétion apparaît tôt dans le DT 2. Son origine est héréditaire (attestée par l’hypo insulinémie de sujets normo glycémiques mais parents au premier degré de DT 2), Une fois l’hyperglycémie installée, l’insulinosécrétion décline avec le temps du fait de la glucotoxicité et de la lipotoxicité [Guillausseau et al., 2008]. Ces anomalies de l’insulinosécrétion sont regroupées sous le terme de dysfonction insulaire [Guillausseau et al.,
2003] et siègent à différent nivaux :
– Anomalie de la pulsatilité de la sécrétion de l’insuline :
Chez les non-diabétiques, l’insuline est sécrétée à l’état basal selon un mode pulsatile, avec des pics de périodicité comprise entre 10 et 15 minutes [Guillausseau et al., 2003]. Cette libération pulsatile de l’insuline est en corrélation avec les oscillations des concentrations intra cytoplasmiques de Ca+2 qui contrôlent l’exocytose des grains d’insuline. Ce caractère oscillatoire pourrait avoir un effet protecteur, car il limite le risque de surcharge calcique de la cellule β car des concentrations élevées et prolongées en Ca+2 sont en effet couplées au déclenchement des signaux d’apoptose de celle-ci. Dans le DT2, il existe une diminution ou une disparition de la sécrétion oscillatoire rapide de l’insuline [Guillausseau et al., 2008].
– Anomalie de la cinétique de la sécrétion de l’insuline :
Chez les sujets non diabétiques, la sécrétion de l’insuline stimulée par l’administration de glucose se produit en 2 phases (cf. figure 5) : la première correspond à la phase précoce (3 à 5 minutes après la stimulation) suivie d’une deuxième phase ou phase tardive marquée par une ascension plus lente et progressive de l’insulinémie. Le pic précoce de l’insulinosécrétion a un rôle pivot dans le passage de l’état de jeûne à l’état nourri, car il inhibe la production glucosée hépatique, supprime la lipolyse et prépare les cellules cibles à l’action de l’insuline [Guillausseau et al., 2008]. Une disparition de cette phase précoce de l’insulinosécrétion à été décrite chez les patients atteints de DT 2 [Guillausseau et al., 2003].
Figure 5 : Phase précoce de l’insulinosécrétion après glucose intraveineux chez des non diabétiques, des intolérants au glucose et des diabétiques de type 2 [Guillausseau et al., 2008].
– Anomalies quantitatives de la sécrétion de l’insuline :
Les patients atteints de DT 2 ont une insulinopénie franche à l’état basal et après charge en glucose (cf. figure 6). [Guillausseau et al., 2003].
Figure 6 : Sécrétion de l’insuline chez des sujets normaux et des sujets diabétiques type 2 après charge en glucose [Brindisi et al., 2007]
Il semble que ces anomalies de l’insulinosécrétion peuvent être expliquées, du moins en partie, par l’hypothèse de susceptibilité génétique (héréditaire) [Guillausseau et al., 2003].
Ces altérations qui apparaissent tôt dans l’histoire de la maladie diabétique, tendent à s’aggraver avec le temps conduisant à une réduction progressive de l’insulinosécrétion.
Différents mécanismes peuvent expliquer cette évolution notamment la glucotoxicité et la lipotoxicité, en effet l’exposition chronique de la cellule β à l’hyperglycémie et à des concentrations élevées d’acides gras libres altère de façon progressive et irréversible l’insulinosécrétion induite par le glucose. Un autre mécanisme incriminé est l’effet toxique sur les cellules β des radicaux libres produits en excès et insuffisamment dégradés au cours du diabète conduisant à une l’apoptose des cellules β qui en résulte [Guillausseau et al., 2008].
Ceci explique pourquoi de « non insulinodépendant » le diabétique type 2 devient « insulino-requérant » avec le temps, et que l’administration de l’insuline devient indispensable pour contrôler et équilibrer l’hyperglycémie.


![Phase précoce de l’insulinosécrétion après glucose intraveineux chez des non diabétiques, des intolérants au glucose et des diabétiques de type 2 [Guillausseau et al., 2008] Phase précoce de l’insulinosécrétion après glucose intraveineux chez des non diabétiques, des intolérants au glucose et des diabétiques de type 2 [Guillausseau et al., 2008]](https://www.institut-numerique.org/wp-content/uploads/2013/10/Phase-précoce-de-l’insulinosécrétion-après-glucose-intraveineux-chez-des-non-diabétiques-des-intolérants-au-glucose-et-des-diabétiques-de-type-2-Guillausseau-et-al.-2008.png)
![Sécrétion de l’insuline chez des sujets normaux et des sujets diabétiques type 2 après charge en glucose [Brindisi et al., 2007] Sécrétion de l’insuline chez des sujets normaux et des sujets diabétiques type 2 après charge en glucose [Brindisi et al., 2007]](https://www.institut-numerique.org/wp-content/uploads/2013/10/Sécrétion-de-l’insuline-chez-des-sujets-normaux-et-des-sujets-diabétiques-type-2-après-charge-en-glucose-Brindisi-et-al.-2007.png)